 |
 |
« geri |
| Rabitə (Yuxarı) | |
| Atomlar niyə bir-biri ilə birləşir | İon rabitəsi | Kovalent rabitə | Metal rabitəsi | |
|
Atomlar niyə bir-biri ilə birləşir Birləşmədəki elementlər bir-birinə güclü şəkildə birləşirlər, beləliklə, onları ayırmaq çətin olur. Təsirsiz qazlar passivdirlər və mürəkkəb birləşmə əmələ gətirmirlər, çünki onların atomları tam xarici elektron təbəqəsinə malikdir. |
|
|
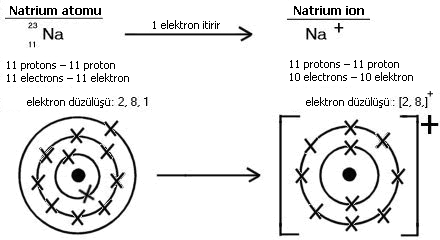
İon rabitəsi Elektronlarını itirən atomlar müsbət yüklü ionlar yaradır, elektronlar qazanan atomlar mənfi yüklü ionlar yaradır. |
|
 |
|
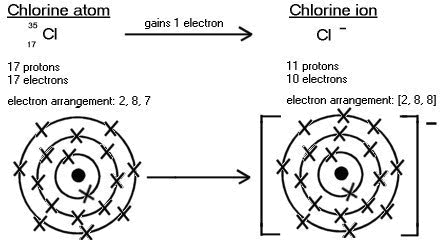
| Xlor atomunun 17 elektronu vardır. Onun elektron düzülüşü 2, 8, 7-dir. Xlor öz xarici təbəqəsini doldurmaq və mənfi yüklü ion yaratmaq üçün bir elektron alır. |
|
 |
|
|
Natrium və xlorid ionları natrium-xloridi NaCl təşkil etmək üçün birlikdə birləşirlər. Düsturda yüklər göstərilmir, çünki onlar neytrallaşmışlar. Siz həmçinin maqnezium-oksid, MgO, və kalsium xlorid, CaCl2-də ionları göstərə bilməlisiniz. İon tərkib hissələri nəhəng ion şəbəkəsi adlanan müntəzəm quruluşlar yaradır. Onlar yüksək ərimə və qaynama nöqtələrinə malikdirlər, çünki ionlar arasında çoxlu güclü əlaqələr vardır. Suda əridikdə və ya həll olduqda, ion tərkibi elektriki keçirir, çünki ionlar hərəkət etməkdə sərbəstdirlər.
|
|
|
Kovalent rabitə Bir çox kovalent rabitəli birləşmələr sadə molekullardır, məsələn, su (H2O) kimi. Hidrogen birinci təbəqədə yalnız bir elektrona malikdir. Bu təbəqə iki elektron saxlaya bilər, belə ki, onu doldurmaq üçün ona bir elektron da lazımdır. Oksigen xarici təbəqəsində altı elektrona malikdir, belə ki, onu doldurmaq üçün daha ikisi lazımdır. Oksigen hər bir hidrogen atomu ilə paylanmış elektron cütünü əmələ gətirir; belə ki, bütün atomlar tam xarici təbəqəyə malikdirlər. Bölünmüş elektronlar cütü kovalent rabitədir. Cütün bir elektronu bir atomdan, digəri isə müxtəlif atomdandır. Kovalent rabitələr yalnız elektronların xarici təbəqələrini göstərərək bunun kimi çəkilir. |
_v2.gif) |
|
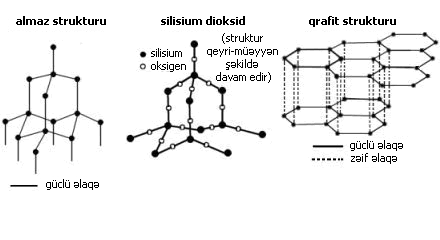
Nöqtə və cızıqlar müxtəlif atomların xarici elektronlarını bildirir. Quruluş diaqramında hər bir xətt bölünmüş elektron cütü – bir kovalent rabitəni göstərir. Siz həmçinin ammonyak NH3, hidrogen H2, hidrogen xlorid HCl, metan CH4 və oksigenin O2-də kovalent rabitələrini göstərə bilməlisiniz. . Sadə molekulyar birləşmələr aşağı ərimə və qaynama nöqtələrinə malikdirlər, çünki molekullar arasındakı qüvvələr zəifdir, baxmayaraq ki, molekullar daxilindəki kovalent rabitələr güclüdür. Onlar elektriki keçirmir, çünki molekulların elektrik yükü yoxdur. Almaz, qrafit və silisium-dioksid atomların nəhəng kovalent rabitəli maddələrdir. Onlar çox yüksək ərimə nöqtələrinə malikdirlər, çünki onların quruluşunda bir çox kovalent rabitələr vardır. Almaz və qrafit hər ikisi karbonun formalarıdır. Almazda hər bir karbon atomu dörd digər karbon atomuna birləşir. Bu 3-D nəhəng kovalent quruluş çox güclüdür. Almaz kristalı nəhəng bir molekuldur. Silisium dioksid eyni struktura malikdir Qrafitdə hər bir karbon atomu qatlarda nəhəng molekullar yaradaraq üç kovalent rabitə əmələ gətirir. Qatlar arasındakı əlaqə zəifdir, belə ki, qatlar üçün bir-biri üzərində hərəkət etmək asandır. Qrafit sərbəst elektronlardan ibarətdir, beləliklə, o elektriki keçirə bilər. |
|
 |
|
|
Metal rabitə Metal atomlarının xarici elektronları bütün quruluş boyunca sərbəst hərəkət edə bilirlər. Bu elektronlar “dənizi” ilə əhatə olunan bərk bağlanmış ion qatları əmələ gətirir. İon və elektronlar üzərindəki yüklər strukturunu birlikdə saxlayır, amma ionlara bir-biri üzərində hərəkət etməyə imkan verir. Ona görə də metallar əyilə və dartıla bilir. Sərbəst elektronlar metala elektrik və istiliyi keçirmək imkanı verir. |
.gif) |
| Copyright ©2015 Edumedia LLC | |
| skoool haqqında Tərəfdaşlar haqqında Toxunulmazlıq və Təhlükəsizlik | |
| EDUMEDIA şirkəti tərəfindən adaptasiya olunub. |
 |