 |
 |
« geri |
|
Metal filizdən faydalı məhsullar (Yuxarı) |
||||||||||||||||||||||||
| Giriş | Dəmirin ayrılması | Alüminiumun ayrılması | Misin Təmizlənməsi | ||||||||||||||||||||||||
| Giriş Yer qabığı metal və mürəkkəb metal quruluşlarından ibarətdir, amma bunlar həmişə digər maddələrlə qarışırlar. Filiz metalı ayırmaq üçün onu sərfəli edən, tərkibində kifayət qədər metal və ya mürəkkəb metal quruluşu olan süxurdur. Bir çox metallar Yer kürəsində mürəkkəb metal quruluşları kimi mövcuddur, amma qızıl çox dirpassivdir, belə ki, sərbəst metal kimi aşkar olunur. O sadəcə fiziki cəhətdən digər maddələrdən ayrılmalıdır. Bəzi metallar digərlərinə nisbətən hava, su və turşular ilə daha güclü reaksiyaya girir. Onlar aktivlik sırasında sadalana bilərlər. Daha aktiv metal daha az aktiv olan metalı əvəz edə bilər. Qeyri metallar karbon və hidrogen öz mürəkkəb quruluşundan daha az aktiv olanı əvəz edəcək. |
||||||||||||||||||||||||
 |
||||||||||||||||||||||||
|
Məsələn, mis öz mürəkkəb quruluşundan gümüşü əvəz edəcək, çünki o aktivlik sırasında ən yüksəkdədir. |
||||||||||||||||||||||||
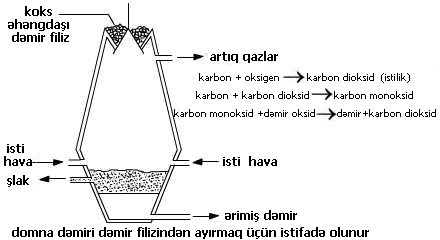
| Dəmirin ayrılması Dəmir karbondan daha az aktivdir, belə ki, domna sobasında karbondan istifadə edərək filizindən ayrıla bilər. |
||||||||||||||||||||||||
 |
||||||||||||||||||||||||
|
|
||||||||||||||||||||||||
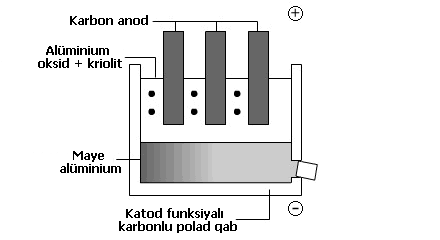
| Alüminiumun ayrılması Alüminium karbon ilə qızdırıldıqda ayrıla bilməz, çünki o çox aktivdir. O elektroliz ilə ayrılır. İon quruluşları suda həll olunduqda və ya əridikdə ionlar hərəkət etməkdə sərbəst olurlar. Mayedən elektrik cərəyanı keçdikdə metal ionları kimi müsbət ionlar elektronlar aldığı mənfi elektroda köçürlər. Bu reduksiyadır. Mənfi ionlar elektronlar itirdiyi müsbət elektroda köçürlər. Bu oksidləşmədir. Bunu xatırlayarsınız: Oksidləşmə elektron itkisidir. Kimyəvi reaksiyada bir şey oksidləşdikdə, bir şey də azalır. Bu reaksiyalar oksidləşmə-bərpa reaksiyaları adlanır. Elektroliz zamanı qazlar ayrıla bilər və ya metallar elektrodlarda saxlana bilər. Alüminiumun istehsalı üçün xammal boksit adlanan alüminium filizindən təmizlənmiş alüminium oksiddir.br /> Alüminium oksid çox yüksək ərimə nöqtəsinə malikdir, belə ki, o kriolit adlanan maye alüminium quruluşunda həll olur. Bu çox istilik enerjisi sərf etmir, ucuzdur, çünki kriolit aşağı ərimə nöqtəsinə malikdir. Elektrodlar karbondan təşkil olunur. |
||||||||||||||||||||||||
 |
||||||||||||||||||||||||
|
Oksid ionları müsbət elektroda köçür və atomlar əmələ gətirmək üçün elektronlarının itirir. Müsbət elektrodda:
Atomlar müsbət elektrodda oksigen molekulları(O2) əmələ gətirir. Bu müsbət elektrodların yanmağa məcbur edir, belə ki, onlar tezliklə əvəz olunmalıdırlar.
Baxmayaraq ki, alüminium aktiv metaldır, o tez paslanmır. Bu ona görədir ki, o səthdə alüminium oksid qatı əmələ gətirərək havada oksigen ilə reaksiyaya girir. Bu gələcək korroziyanın qarşını alaraq su və oksigen üçün maneə olur. Maqnezium kimi digər metalların kiçik miqdarları ilə qarışdırılaraq ərinti almaq üçün o daha bərk, möhkəm və daha sərt edilir. |
||||||||||||||||||||||||
|
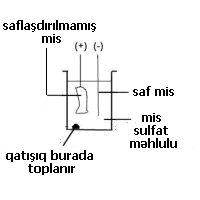
Misin təmizlənməsi Amma bu yolla ayrılmış misin tərkibində çox qarışıqlar olur və elektrik naqillərinin çəkilməsi üçün istifadəyə yararsızdır.
|
 |
|||||||||||||||||||||||
| Copyright ©2015 Edumedia LLC | |
| skoool haqqında Tərəfdaşlar haqqında Toxunulmazlıq və Təhlükəsizlik | |
| EDUMEDIA şirkəti tərəfindən adaptasiya olunub. |
 |