 |
 |
« geri |
| Kəmiyyət Kimyası (Yuxarı) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nisbi Atom Kütləsi | Nisbi molekul Kütləsi | Mürəkkəb quruluşların faiz tərkibi | Reagent və ya Məhsulların Kütləsinin hesablanması Formulların hesablanması | Elektroliz hesablamalar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Nisbi Atom Kütləsi Kimyaçılar adətən reaksiyada nə qədər kimyəvi maddənin istifadə olunacağını və ya hasil olacağını bilməlidirlər. Atomlar, ionlar və molekullar hesablanmaq və ya çəkmək üçün çox kiçikdirlər. Belə ki, elementin böyük sayının orta kütləsindən istifadə olunur. Atomların sayı mol və bir molun kütləsi nisbi atom kütləsi Ar adlanır. Bu qiymət dövri elementlər cədvəlində hər bir element üçün işarənin yanında yazılmış üst nömrə kimi verilir. Bəzi elementlərin nisbi atom kütlələri:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Nisbi molekul Kütləsi Su molekulunda iki hidrogen və bir oksigen atomu vardır.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Mürəkkəb molekulların faiz tərkibi Onun nisbi molekul kütləsi: 12 + 1 + 1 + 1 + 1 = 16
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reagent və ya Məhsulların Kütləsinin hesablanması Tarazlaşdırılmış bərabərlikdən bütün kimyəvi maddələrin miqdarını hesablamaq mümkündür.
Reaktivlərin ümumi kütləsi həmişə məhsulların ümumi kütləsinə bərabər olur. Bununla belə, 1q kalsium karbonat 44/100q karbon dioksid hasil edəcək.
Bəzən reaksiyada hasil olan qazın həcmini hesablamaq lazım olur. İstənilən qazın nisbi molekul kütləsi 25ºC-də 24 litr həcmə və 1 atmosfer təzyiqinə malikdir. Beləliklə, bu reaksiyada hasil olan karbon dioksidin həcmini hesablamaq üçün:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
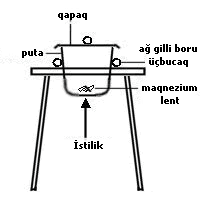
Formulların hesablanması Məsələn, maqnezium oksidin formulunu maqneziumun məlum kütləsini qabda yandırmaqla və əmələ gələn maqnezium oksidin miqdarını ölçməklə tapmaq olar. |
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2.4 q maqnezium 1.6 q oksigenlə birləşib. Hər bir elementin mol sayı buradan tapılır:
Maqneziumun 0.1 molu 0.1 mol oksigenlə reaksiyaya girib.
Hidrogenin 1 molu 0.5 mol kükürdlə reaksiyaya girir. Hidrogen sulfidin formulu H2S olur. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroliz hesablamalar Sizə elektroliz məhsullarının birinin kütləsi verilibsə və yarım reaksiyaları bilirsinizsə, digər elektroddakı məhsulun kütləsini hesablaya bilərsiniz. Məsələn, natrium xlorid məhlulunun elektrolizi üçün yarım reaksiyalar vardır:
10q hidrogenin əmələ gəldiyini bilirsinizsə, hasil olan xlorun kütləsini hesablaya bilərsiniz.
Ar hidrogen = 1, beləliklə, Mr H2 = 2 Ar xlor = 35.5, beləliklə, Mr Cl2 = 71
Hasil olan hidrogenin hər molu üçün eyni xlor molu hasil olur.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Copyright ©2015 Edumedia LLC | |
| skoool haqqında Tərəfdaşlar haqqında Toxunulmazlıq və Təhlükəsizlik | |
| EDUMEDIA şirkəti tərəfindən adaptasiya olunub. |
 |