|
 |
« geri |
| Reaksiyalarda enerji ötürülmələri (yuxarı) |
||||||||
| Kimyəvi reaksiyalarda enerji ötürülmələri | Ekzotermik reaksiyalar | Endotermik reaksiyalar Dönən Reaksiyalar | Enerji Səviyyəsi Diaqramları Rabitədə enerjinin hesablanması | Aktivləşdirmə enerjisi |
||||||||
| Kimyəvi reaksiyalarda enerji ötürülmələri
Kimyəvi reaksiya yaranan kimi enerji adətən ətrafa və ya ətrafdan ötürülür. Məsələn, salyutlar yanarkən onlar enerjini işıq, istilik və səs formasına verirlər. |
||||||||
|
Ekzotermik reaksiyalarda enerji adətən istilik formasına verilir. Bu, temperaturun qalxması ilə aşkar oluna bilər. Ekzotermik reaksiyalar çox sadədir. Məsələn:
Susuz mis sulfat + su This colour change is used as a test for water. |
||||||||
|
Endotermik reaksiyalarda ətrafdan enerji istilik kimi alınır. Bu temperaturun düşməsi ilə aşkar oluna bilər. Endotermik reaksiyalar çox sadə deyillər. Bəzi misallar:
|
||||||||
|
Reaksiya bir istiqamətdə ekzotermikdirsə, onda əks istiqamətdə endotermik olacaq. Hər halda eyni enerji miqdarı ötürülür. mis sulfat kristalhidratı [+ istilik enerjisi] Birbaşa isidilməlidir. O, enerjini udur, endotermikdir. Əks reaksiya ekzotermikdir və istilik verir. |
||||||||
|
Rabitələri qırmaq üçün enerji təchiz edilməlidir. Enerji abitələr əmələ gəldikdə buraxılır. Ekzotermik reaksiyada yeni rabitələrdən buraxılan enerji mövcud rabitələri qırmaq üçün olan enerjidən daha böyükdür. In an endothermic reaction the energy needed to break existing bonds is greater than the energy released from forming new bonds. Bu enerji dəyişiklikləri enerji səviyyəsi diaqramlarında göstərilə bilər.
Ötürülmüş enerjinin miqdarı reagentlərdə olan enerjinin məhsullarda olanla müqayisə etdikdə tapılır. |
||||||||
|
Əlaqədə enerjinin hesablanması Ötürülən enerjinin miqdarını hesablamaq üçün digər üsul məlum əlaqə enerji dəyərlərindən istifadə etməkdir. Hər bir kimyəvi əlaqə, onun hansı tərkibdə baş verməsindən asılı olmayaraq müvafiq əlaqə enerjisinə malikdir. Havada yanan hidrogen üçün reaksiya: 2H2 + O2 Bu iştirak edən kimyəvi maddələrin struktur formulundan istifadə etməklə də yazıla bilər. 2 (H-H) + O=O Əlaqə enerjiləri:
Reaksiya baş verməzdən əvvəl hidrogen və oksigendəki atomlar arasında rabitələr pozulmalıdır.
Hidrogenin iki molekulu və oksigenin bir molekulu üzərindəki rabitələr pozulmalıdır. 2 x H-H = 2 x 436 O=O = 498 kC
Hər su molekulunda iki O-H rabitəsi vardır. Suyun iki molekulu əmələ gəlir, bununla da birlikdə dörd O-H rabitəsi yaranır. 4 x 464 = 1856 kC Alınana nisbətən daha çox verilir, reaksiya ekzotermikdir. Bu reaksiya üçün verilən enerjinin miqdarı 1856 – 1370 = 486 kC |
||||||||
|
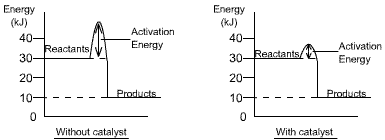
Bəzi reaksiyalara getmək üçün enerji lazımdır. Tələb olunan enerjinin minimum miqdarı aktivləşdirmə enerjisi adlanır və tez-tez enerji səviyyəsi diaqramlarında göstərilir. The amount of activation energy does not affect the overall energy change for the reaction. It is not included in the calculation. Katalizatordan istifadə olunduqda reaksiya sürətlə gedir, çünki o tələb olunan aktivləşdirmə enerjisinin miqdarını azaldır, beləliklə, daha çox toqquşmaya müvəffəq olur.
Qrafiklər eyni kimyəvi reaksiya üçün enerji ötürülməsini göstərir. Katalizator istifadə olunduqda aktivləşdirmə enerjisi az olur, amma ümumi enerji ötürülməsi eynidir. Bu misalda 20 kC enerji verilir. |
| Copyright ©2015 Edumedia LLC | |
| skoool haqqında Tərəfdaşlar haqqında Toxunulmazlıq və Təhlükəsizlik | |
| EDUMEDIA şirkəti tərəfindən adaptasiya olunub. |
 |